

胰腺癌由于其極差的生存預后素有“癌王”之稱,患者5年生存率僅為10%左右[1],造成這種現象的主要原因之一,是臨床治療選擇有限、且整體效果較差,尤其是對晚期胰腺癌,目前系統性藥物治療主要為FOLFIRINOX方案及吉西他濱為基礎的化療[2],但化療效果非常有限,仍需開發新的治療方式。
基于免疫檢查點抑制劑的免疫療法,是一種新興的腫瘤治療手段,已改變大多數實體瘤治療的格局,但在胰腺癌中卻收效甚微,例如,PD-1抗體聯合CTLA-4抗體治療轉移性胰腺癌的客觀緩解率僅為3.1%[3]。
胰腺癌對免疫檢查點抑制劑無反應的主要原因,是腫瘤微環境為免疫抑制性,特征為髓系細胞大量浸潤及CD8+T細胞功能障礙[4,5]。因此,進一步明確胰腺癌微環境的免疫抑制特征并針對性解決,對于改善免疫檢查點抑制劑的治療效果至關重要。
近日,由美國MD安德森癌癥中心Ronald A. DePinho教授領銜的研究團隊在Nature Cancer發表了一項重要研究成果。研究發現,胰腺癌微環境中存在明顯的髓系細胞浸潤和T細胞功能失調,針對這種免疫抑制表型,使用41BB激動劑及CXCR1/2抑制劑聯合免疫檢查點LAG3抑制劑,實現持續性的腫瘤緩解[6],這或許可以成為胰腺癌治療的新策略。
為明確胰腺癌微環境特征,Ronald A團隊構建了基于基因工程的胰腺癌自發成瘤鼠模型并對其進行生物發光及影像學檢測(圖1)。隨后,他們通過CyToF法對腫瘤浸潤性免疫細胞進行了檢測,使用標準化決策樹分析(SPADE)對微環境中的免疫細胞亞群進行了歸類。
Ronald A團隊發現,這種自發瘤模型與人胰腺癌組織中的免疫細胞成分及比例相近。他們使用多重免疫組化分析發現,小鼠胰腺癌組織中CD8+T細胞的比例和分布與人胰腺癌組織相近(圖2a),且CD33+CD11b+CD66b+的中性粒細胞和CD33+CD14b+CD68b+的腫瘤相關巨噬細胞的分布和比例在兩種組織中也很相似(圖2b),這表明構建的小鼠模型具有較高的人類模型模擬度和保真度。
Ronald A團隊通過SPADE分析發現,骨髓來源免疫抑制細胞(MDSCs)和巨噬細胞為胰腺癌微環境中的主要免疫細胞亞群(圖3),此外,他們還檢測了腫瘤內記憶性和細胞毒性CD8+T細胞,發現這些T細胞會出現耗竭或者功能失調的情況。
為進一步明確腫瘤內T細胞的特征,Ronald A團隊使用無監督聚類法將T細胞分為6簇:中央記憶性CD4+T細胞、Treg細胞、中央記憶性CD8+T細胞、細胞毒性CD8+T細胞、耗竭性CD8+T細胞和高度復制的CD8+T細胞。
Ronald A團隊發現,激活性免疫檢查點41BB和Ox40、抑制性免疫檢查點LAG3、PD-1、CTLA-4和TIM3在耗竭性CD8+T細胞中表達,而在其他類型的CD8+T細胞中不表達(圖4)。
基于以上結果,Ronald A團隊分別使用了41BB、Ox40靶點激動劑,以及LAG3、PD-1、CTLA-4和TIM3位點的抑制劑,對胰腺癌小鼠進行治療,結果顯示,相比于其他組,經41BB激動劑及LAG3抑制劑治療的小鼠出現明顯的腫瘤抑制及生存改善(圖5a,b),且兩者聯合后可進一步抑制腫瘤生長并改善小鼠生存(圖5c,d),但腫瘤仍然無法完全消除,小鼠仍然會因腫瘤死亡(圖5d)。
Ronald A團隊發現,與對照組及無效治療組(PD-1及CTLA-4抑制劑)相比,41BB激動劑及LAG3抑制劑顯著改善了T細胞的耗竭表型,且腫瘤內T細胞的信號轉導、細胞因子產生、增殖和細胞溶解活性均上調,還增加了T細胞的克隆性和多樣性,減少了免疫抑制性的髓系細胞,增加抗原呈遞從而促進抗腫瘤免疫反應。
然而,41BB激動劑及LAG3抑制劑聯合后仍不能完全消除腫瘤,這表明還需靶向其他免疫抑制機制,來進一步提升療效。研究者重新注意到了胰腺癌組織中大量存在的MDSCs,發現粒細胞或中性粒細胞MDSCs中存在CXCR2的過度表達,而CXCR2在將MDSCs招募到腫瘤組織中起到了關鍵作用。
因此,研究者們將目標鎖定為CXCR2,探索了在研CXCR1/2抑制劑SX-682的效果:經SX-682治療后,腫瘤內MDSCs浸潤減少(圖6),CD8+T細胞浸潤增加,樹突狀細胞浸潤輕度增加,腫瘤相關巨噬細胞浸潤無顯著改變,這表明CXCR1/2信號在髓系細胞介導的胰腺癌免疫抑制中發揮重要作用,而SX-682或可聯合LAG3抑制劑及41BB激動劑,發揮更強大的抗腫瘤效果。
隨后研究者們使用了“41BB激動劑+LAG3抑制劑+SX-682”的聯合方案,對胰腺癌小鼠進行治療,發現這種聯合方案可使得大部分小鼠腫瘤完全消退,且90%小鼠在停止治療18個月后仍然存活(圖7),這表明這套“組合拳”或可產生持久性的腫瘤消退作用。
綜上所述,這項研究揭示了胰腺癌免疫抑制性微環境的細胞特征,并據此發現了一種潛在的胰腺癌免疫聯合治療創新方案,有望突破胰腺癌免疫治療效果差、生存率低的瓶頸,期待該方案能夠盡快進入臨床驗證階段。


全國共有49家實驗室報名參加,其中45家提交有效結果,僅23家通過評價活動,通過率為51.1%。

由中國臨床腫瘤學會(CSCO)主辦的"2020年中國臨床腫瘤學年度進展研討會"近日于線上順利召開,會上專家學者們對2020CSCO消化道腫瘤指南更新做了總結,近幾年頗受關注的免疫治療在新版指南中地位突顯,地位相較于舊版指南有所提升。
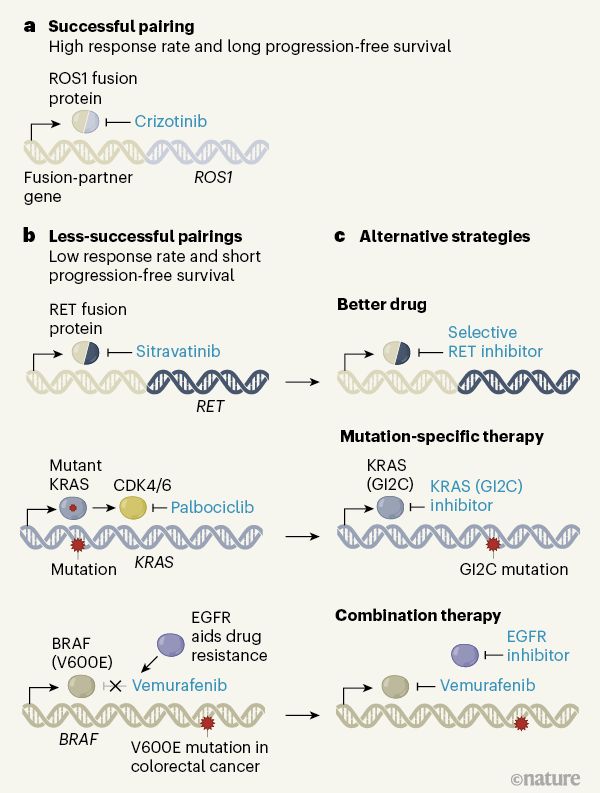
由伯明翰大學癌癥研究中心英國臨床試驗小組領導的一項開拓性的肺癌研究強調了下一波精準醫學研究,特別是治療基因組復雜癌癥需要考慮的重要因素。