

當地時間8月1日,有報道聲稱,美國癌癥研究機構希望城市(City of Hope)在臨床前研究中,已經開發出一種能殺死所有實體惡性腫瘤的靶向藥。
“癌癥就要被攻克了”,這樣的說法在一些報道里甚囂塵上,這種抗癌藥的臨床前研究,也已經以論文的形式發表在《細胞化學生物學》期刊上。但科學家強調道,這種藥物還在初步試驗階段,距離實際應用還有很遠的距離。
這研究究竟說了什么,它真的那么厲害嗎?
抑制“事故調解員”
在這項研究中,科學家們制造出了一種名叫“AOH1996”的抗癌藥物備選,并對它的作用原理和效果進行了初步的探尋。
這種物質運用了新穎的原理來抑制癌細胞生長:簡單說,它抑制了細胞內的一位“事故調解員”,讓癌細胞在不斷累積的事故中自取滅亡。
這種細胞內的事故就是轉錄復制沖突(Transcription Replication Conflicts)。我們可以把它簡單地理解為一種發生在DNA分子上的“撞車”事件。
當細胞進行增殖時,有兩種酶都會沿著DNA分子鏈展開繁忙的工作:一個是復制基因組的DNA聚合酶,另一個則是把部分基因信息進行轉錄的RNA聚合酶。當這兩個酶恰好在同一段DNA鏈上工作時,它們有時會“撞到一起”,這就造成了轉錄復制沖突。這種沖突不僅妨礙了酶的工作,還會帶來DNA鏈斷裂之類嚴重的后果。
為避免基因組受損,細胞內有一系列機制可以預防和解決這種事故。比如說,解決方法之一是將RNA聚合酶暫時從DNA分子上“踢下去”,好讓DNA聚合酶順利通過。
而AOH1996就是一種為干擾事故調解而設計的分子。它會結合并抑制名叫增殖細胞核抗原(PCNA)的蛋白質,讓轉錄復制沖突無法順利解決。接下來,沖突事故累積的負面影響就會讓癌細胞無法繼續復制,還會導致它們走向凋亡。
選擇性抑制
在對癌細胞的抑制之外,AOH1996的另一亮點是它對健康細胞較高的安全性。初步的毒理學實驗發現,即使給藥劑量達到了有效劑量的6倍以上,實驗小鼠與實驗狗仍未出現明顯的毒性反應。
這種新藥備選所針對的蛋白質PCNA在所有的真核細胞中廣泛存在,而且在DNA 復制/修復過程中起著重要的作用。如果把所有細胞的PCNA蛋白全部抑制,應該會帶來很多麻煩——但幸運的是,在健康細胞和癌細胞當中,這個蛋白質的結構特征存在一些差異。這種差異使得研究者能夠設計出選擇性作用于癌細胞的化學分子。
真能殺死所有腫瘤嗎?
在現有的研究中,藥物備選AOH1996的表現看起來確實不錯。
研究者首先用體外培養的70多種腫瘤細胞進行了實驗,結果發現這種分子廣泛地抑制了腫瘤細胞生長,同時不會干擾對照組健康細胞的增殖。隨后他們又用移植了人類腫瘤的實驗小鼠進行測試,在這些老鼠身上,AOH1996也成功縮小了腫瘤體積,同時還增強了其他化療藥物的作用。
但需要強調的是,這些細胞與動物實驗都很初步,下結論還為時過早。
一方面,目前動物實驗的樣本量很小,藥物的測試時間也只有短短幾天;另一方面,即使移植的是來源于人類的腫瘤,實驗小鼠與人類也依然有很多差異,結論無法直接外推。
目前,這種藥物備選才剛剛開始進行I期臨床實驗,它是否真能成功還要看后續研究結果。在論文結尾,研究者也特別強調了目前成果的局限性:“我們承認,積極的動物研究結果并不總能轉化為治療癌癥患者的成功。它對癌癥治療的效果仍需未來的臨床研究確認。”


全國共有49家實驗室報名參加,其中45家提交有效結果,僅23家通過評價活動,通過率為51.1%。

由中國臨床腫瘤學會(CSCO)主辦的"2020年中國臨床腫瘤學年度進展研討會"近日于線上順利召開,會上專家學者們對2020CSCO消化道腫瘤指南更新做了總結,近幾年頗受關注的免疫治療在新版指南中地位突顯,地位相較于舊版指南有所提升。
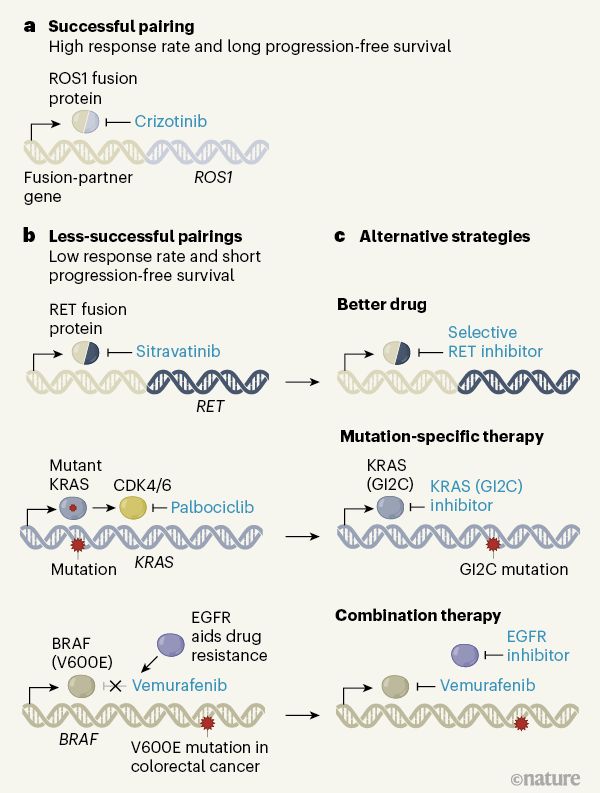
由伯明翰大學癌癥研究中心英國臨床試驗小組領導的一項開拓性的肺癌研究強調了下一波精準醫學研究,特別是治療基因組復雜癌癥需要考慮的重要因素。